Елена Бабичева
Спасение холодом: возможно ли создать криобанки донорских органов

Как сохранить донорский орган пригодным для трансплантации в течение многих дней и даже месяцев? Насколько вероятно создание криобанков донорских органов? Научный мир уже десятки лет пытается найти ответы на эти вопросы. Кровь5 – о том, как устроена криоконсервация и почему она может изменить трансплантологию.
Трансплантация органа подчас последняя возможность спасти жизнь, но не далеко не всегда она реализуется. Причина не только в том, чтобы найти совместимый донорский орган, но и в том, чтобы он оказался в нужное время в нужном месте.
В случае, когда пациента отключают от аппаратов, которые поддерживают жизнедеятельность, его органы остаются жизнеспособными очень недолгое время. Чтобы подключить их к кровоснабжению реципиента, у врачей есть меньше суток. Временное окно, в течение которого можно провести трансплантацию, для сердца и легкого составляет 4–6 часов, для печени – 8–12 часов, для почки – до 24 часов.
Необходимость действовать в условиях цейтнота создает массу проблем: неурочный вызов хирургов и трансплантологов для изъятия и пересадки органа, невозможность провести предварительную иммунологическую подготовку реципиента, чтобы минимизировать риск отторжения донорского органа, затраты на его срочную доставку в трансплантационный центр. Всегда есть вероятность не уложиться во временные рамки. В том числе из-за этого, по статистике, до 60% донорских сердец и легких так и не доходят до тех, кто отчаянно в них нуждался.
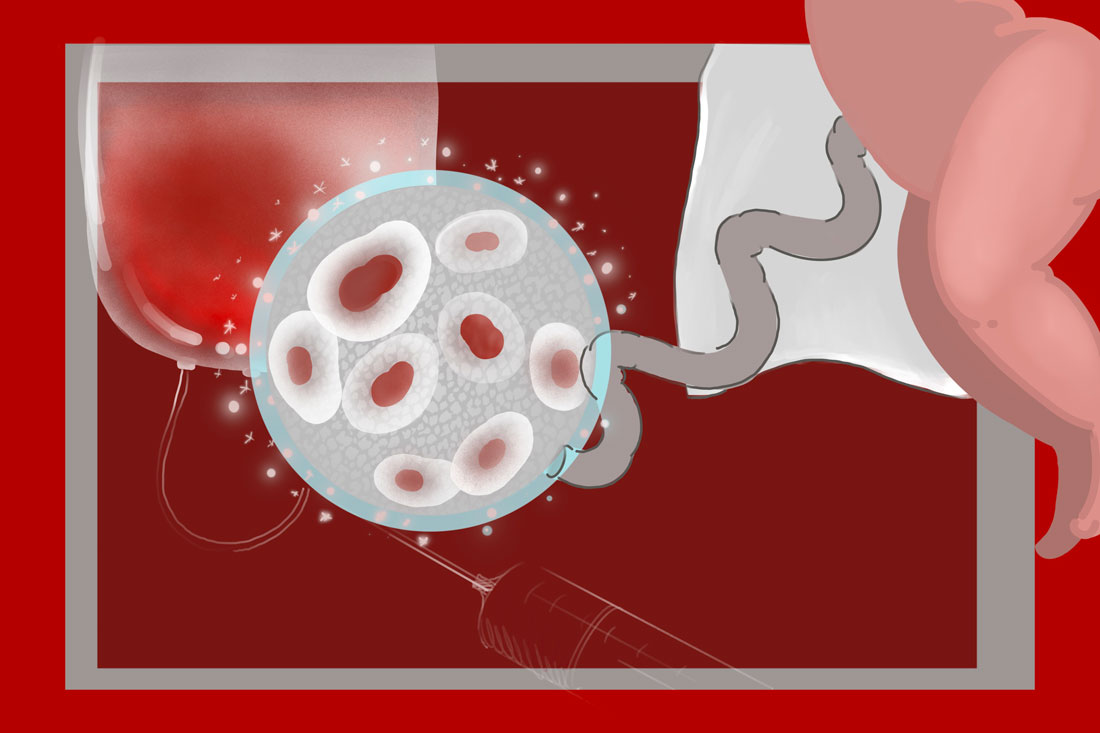
Криоконсервация по идее дает возможность хранить органы длительное время, прежде чем они будут пересажены.
Вместо того чтобы утилизировать их из-за невозможности использовать. Она также позволяет врачам подбирать более подходящие реципиентам донорские органы. Так что если ученые смогут преодолеть барьеры, которые пока есть в области криоконсервации, то наука вплотную приблизится к решению амбициозной задачи – созданию хранилищ донорских органов.
Губительный лед
Процесс криоконсервации основан на свойстве организма в состоянии глубокого охлаждения приостанавливать химические реакции, биологические процессы, в том числе обмен веществ, энергообмен, физическую внутри- и внеклеточную активность.
При температуре от 0°С до минус 25°С ферментативная активность клеток лишь замедляется, замораживается она при температуре минус 40°С и ниже. Но такие ультранизкие температуры на самом деле губительны. Когда температура понижается с плюс 37°С до минус 196°С (это стандарт криоконсервации), в клетке происходят повреждения.
Во внутриклеточных пространствах образуются кристаллы льда, одновременно наступает обезвоживание. Все это приводит к клеточной деформации.
Долгое время ученые решали проблему, как довести ткань до замерзания, но при этом избежать образования льда. Решение нашлось в 1949 году, когда были обнаружены криозащитные свойства глицерина.
С тех пор были открыты другие вещества с похожими свойствами, которые по-разному воздействуют на клетку. Одни, подобно глицерину, имеют низкую молекулярную массу и проникают через мембрану клетки. Другие, например поливинилпирролидон, гидроксиэтилкрахмал и некоторые сахара, имеют большую молекулярную массу, поэтому действуют вне клетки. Но сам механизм воздействия в обоих случаях примерно сходен.
При охлаждении криозащитные вещества образуют водородные связи с водой, позволяющие сохранять жидкое состояние при температурах ниже точки замерзания. Присутствие как внутри-, так и внеклеточных криопротекторов позволяет блокировать процесс кристаллизации.
Правда, с криопротекторами тоже не все просто. Слишком высокая их концентрация может быть токсичной для клетки и вызвать ее повреждение. Да и сам по себе криозащитный раствор может задерживать воду в цитоплазме и стимулировать таким образом кристаллизацию льда. Нужен был точный математический расчет, чтобы понять, как именно наносить криопротекторы, когда их удалять и какова должна быть продолжительность их контакта с клеткой.
Скорость решает
В 1985 году криобиолог Грег Фэйи и его коллега из Американского Красного Креста Уильям Ралл открыли химический процесс, позволяющий хранить эмбрионы мышей при температуре почти минус 200°C. Их технология устраняла главный барьер на пути замораживания живых тканей – лед.
Замерзающая вода может нанести ущерб тканям. Молекулы воды превращаются из аморфной жидкости в жесткую кристаллическую решетку, и кристаллы льда пронзают клетки, как ножи. В тех частях ткани, которые замерзают последними, концентрируются соли на токсичных уровнях.
Ткань напоминает размороженную клубнику – размягченную и обесцвеченную.
Исследователи провели экстремально быстрое замораживание эмбриона с добавлением криопротектора. В результате получили не лед, а твердое вещество, похожее на стекло. Этот процесс известен как стеклование.
Собственно, все методы криоконсервации основаны на скорости замораживания. Например, для ткани яичника и кожи применяется медленное замораживание, при котором происходит относительно свободное образование кристаллов льда и их рост. Для этих органов такое не критично, но для более крупных имеет фатальное значение. Поэтому для них используют метод, при котором процесс понижения температуры идет с постоянной скоростью, что позволяет регулировать рост кристаллов льда.
Наиболее передовой считается технология быстрого замораживания – витрификация. Она основана на очень высоких скоростях: сначала замораживания, чтобы предотвратить образование кристаллов льда, затем нагревания, чтобы избежать процесса расстеклования (раскристаллизации).
Простые и сложные
Различные ткани и клетки по-разному реагируют на процесс замораживания. Однородные ткани, чтобы обеспечить функционирование исходной популяции клеток (например, сперматозоиды) или деление из клеток-предшественников (костный мозг), могут храниться достаточно долго. Гораздо сложнее обстоит дело с органами, состоящими из структур и тканей различной природы (сосудов, костей, хрящей, сухожилий, связок, нервов и т. д.). Эти органы имеют различные клеточные элементы, и у каждого своя собственная реакция на процессы замораживания и оттаивания.
Сегодня большинство органов, которые удалось заморозить и затем успешно трансплантировать, относятся как раз к имеющим простую структуру. Это в первую очередь кожа, роговица и костно-хрящевая ткань.
Случаи криоконсервации и пересадки более сложно устроенных органов единичны.
Так, ученым удалось заморозить ткань яичника, который восстановил свои функции после оттаивания и пересадки. Трансплантация проводилась и животным, и позднее людям – и они впоследствии смогли дать потомство.
Успешным оказался эксперимент с криоконсервацией и последующей трансплантацией задних лапок у крысы, хотя их функции восстановились не в полном объеме.
Удалось трансплантировать ампутированные пальцы человека, которые в течение месяца подвергались криоконсервации.
Однако все это органы, не содержащие сложную мышечную ткань. Более крупные имеют и более сложную структуру и выполняют более хитроумные функции, которые могут нарушиться в результате криоконсервации. Например, нежная капиллярная сеть почек из-за замораживания и последующего наносогревания может быть повреждена, что приведет к ее дисфункции.
В крупных органах сложнее добиться равномерного впитывания криопротектора, а для затвердевания может потребоваться больше времени, что способствует образованию льда.
Свои проблемы создает и процесс нагревания. Слишком медленное может вызвать явление кристаллизации в той части, которая еще не успела оттаять. Неравномерное нагревание приводит к неравномерному расширению клетки, в итоге она может расколоться, как кубик льда, брошенный в стакан с водой.
Опытным путем
Сегодня немало исследований направлено на поиск способов заморозить орган без образования льда. В этом отношении большой интерес для ученых представляет древесная лягушка, обитающая на большей части территории Северной Америки. При температуре минус 16°C две трети ее тела замерзают, но в тепле даже через несколько месяцев заморозки она оживает.
– С наступлением зимы у этой лягушки происходит целый комплекс физиологических изменений, который готовит ее к выживанию при замерзании, – рассказывает Шеннон Тессье из Массачусетской больницы общего профиля, которая изучает животных, впадающих в спячку при температуре, близкой к замерзанию. – Печень лягушки вырабатывает глюкозу, которая действует как антифриз внутри тканей. Уровень антиоксидантов в них повышается, защищая от повреждений, вызванных внезапными изменениями количества кислорода в клетках. Специальные белки в кровотоке лягушки действуют как зародыши кристаллов льда, направляя рост льда в более прочные сосуды, а не в другие, более деликатные ткани. Эти свойства мы хотим взять на вооружение, чтобы перенести на человеческие органы и ткани.
В 2019 году группа исследователей под руководством Тессье провела эксперимент: человеческую печень наполнили синтетическим сахаром, который, в отличие от природной глюкозы, не может метаболизироваться в токсичные побочные продукты.
Этот подход позволил хранить печень при температуре минус 4°C в течение 27 часов – вдвое дольше стандартного времени хранения донорской печени в состоянии, пригодном для пересадки.
Затем ученые объединили синтетический сахар с веществом, которое обычно используют в машинах для производства снега на горнолыжных курортах, чтобы провести криоконсервацию печени крысы. Это вещество действует так же, как белок в крови древесной лягушки, и, концентрируясь в кровеносных сосудах печени, замедляет образование льда. Исследователям удалось сохранить орган частично замороженным в течение пяти дней при температуре минус 15°C. При оттаивании отмечались лишь небольшие нарушения в его функционировании.
Помешать образованию льда можно с помощью высокого давления – этот метод разрабатывает Борис Рубинский из Калифорнийского университета в Беркли. Он обратил внимание, что при замерзании воды внутри герметичных металлических контейнеров давление повышалось и вода расширялась, ограничивая образование льда. В прошлом году его команда провела исследование, охладив донорское сердце свиньи до минус 4°C и хранив его замороженным в течение 21 часа в одной из барокамер. Затем провели нагревание органа и его трансплантацию другой свинье, у которой удалось запустить самостоятельное сердцебиение. По мнению Рубинского, эта технология позволит ограничить использование криопротекторов, которые несут потенциальные токсические эффекты.
Как видно, до создания криобанков донорских органов пока еще далеко. Но даже те открытия в криоконсервации, которые уже сделаны, позволяют врачам выиграть несколько часов, чтобы сохранить орган в пригодном для пересадки состоянии, а значит, шансы на спасение растут.