«Тема искусственной крови
активно поддерживается военными»
Кровь – одна из самых изученных и одновременно самых загадочных жидкостей нашего организма. Испокон веков люди пытались разгадать ее функции, а затем воссоздать в лабораторных условиях. Почему до сих пор не изобретена искусственная кровь, бывает ли абсолютно безопасное переливание крови и можем ли мы сегодня сконструировать тромбоцит, Кровь 5 рассказал биофизик Михаил Пантелеев.
Наша справка:
Михаил Пантелеев, директор Центра теоретических проблем физико-химической фармакологии РАН, профессор МГУ имени М.В. Ломоносова и Московского физико-технического института, заведующий лабораторией клеточного гемостаза и тромбоза НМИЦ детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева

– Мечта о создании универсальной искусственной крови, которую можно было бы просто изготавливать, долго хранить и перевозить на большие расстояния, преследует человечество не один десяток лет. На каком этапе сейчас находятся разработки?
– Начнем с того, что кровь – это система, которая не существует за пределами организма. Она немедленно начинает изменяться. Поэтому попытка сохранить или создать сразу цельную кровь не очень перспективна.
Более того, у врачей нет потребности в полностью искусственной крови. Обычно у пациента есть конкретная проблема, которую можно решить с помощью отдельных компонентов.
И эти компоненты, кстати, лучше не смешивать вместе.
– Почему?
– Переливание крови, даже самой проверенной, всегда подразумевает набор рисков. Самый очевидный связан с заражением вирусами или прионами – особыми патогенными белками. Несмотря на развитие науки, многие из них практически не детектируются современными методами. Вирусы в крови сложно обнаружить у человека в начале болезни, когда они в низкой концентрации, а кровь при этом уже может быть заразной. Кроме того, они очень разнообразны, а тестовые системы все-таки конечны по своему количеству и настроены на определенные виды, к тому же вирусы имеют разную устойчивость к разным вариантам инактивации. Прионы, которые, как известно, вызывают нейродегенеративные заболевания, обнаружить и инактивировать фактически невозможно. Тесты детекции прионов стоят запредельно дорого. Так что, если мы хотим сделать по-настоящему качественное переливание крови, это будет чудовищно дорого. И при этом все равно никто не даст стопроцентной гарантии.
– Другие риски связаны с иммунным ответом?
– Да, потому что риск срабатывания защитных систем организма не сводится к нулю, как бы мы ни полировали наше представление о группах крови. При этом, естественно, в зависимости от компонентов риски будут разными. Наконец, переливание любого компонента просто несет те или иные виды нагрузки на организм, поэтому лучше переливать строго то, что нужно пациенту в конкретной ситуации, и не нагружать организм ненужным.
– Какие компоненты переливать наиболее опасно?
– Пожалуй, максимально высокие риски при переливании лейкоцитов, так как это активные иммунные клетки, которые богаты по своему составу, по определению настроены на борьбу с чужими и измененными клетками и, соответственно, могут сами иметь нежелательную активность и вызывать самый недружелюбный ответ со стороны организма. А вот плазму, как противоположный случай, можно обезопасить в гораздо большей степени.
Возвращаясь к началу разговора, повторюсь, что все-таки в современной медицине задача создания цельной искусственной крови скорее не стоит. Зато можно говорить, что мы разрабатываем аналоги существующих компонентов крови. И стараемся наделить их теми же самыми функциями, которыми есть в компонентах естественных.
Кровь как кровь
– Какие функции крови нужны чаще всего?
– На самом деле критических функций не так много. В первую очередь это объем циркулирующей крови. В сосудистой системе должно быть достаточно жидкости, чтобы могло работать сердце. Вторая функция связана с переносом кислорода; но она далеко не всегда первостепенна для врача (пациент в реанимации не нуждается в тех объемах кислорода, что бегун на стадионе). Третья – гемостатическая, связана с остановкой кровотечений. Она происходит по двум связанным механизмам: плазма крови обеспечивает свертывание – желирование жидкой части крови, а тромбоциты слипаются друг с другом и перекрывают поток пробкой. Четвертая функция – иммунная. Совокупность антител, лейкоцитов и всего прочего, что помогает бороться с вторжениями. Эти четыре функции с разными нюансами обычно рассматривает врач-трансфузиолог, когда ведет больного.
Но если мы говорим не о мгновенной потери крови, а о каком-то заболевании, то акценты будут другими.
Например, тромбоциты не только останавливают кровотечения, но и являются носителями большого количества факторов роста. Они играют огромную роль в локальной регенерации, поддержании целостности сосудистой стенки и т. п.
А свертывание крови в значительной степени управляет ангиогенезом – ростом сосудов. Поэтому для человека с ранением и острой кровопотерей достаточно только гемостатической функции тромбоцитов и свертывания, а если, например, у него от рождения тромбоцитопения, то есть он живет с низким уровнем тромбоцитов, ему нужны компоненты, которые будут наделены всеми этими функциями.
– Насколько я понимаю, сегодня с помощью искусственных веществ научились наиболее качественно заменять первую функцию крови – восстановление объема?
– Да, в простейшем случае с этой задачей справляется физраствор. Фактически это вода с хлоридом натрия – главным солевым компонентом плазмы крови. Продвинутые варианты имеют улучшенный солевой состав, стабилизированную кислотность, туда добавляют желатин и альбумин, чтобы были корректные параметры вязкости и чтобы жидкость не так быстро уходила в ткани. Таких растворов зачастую достаточно, чтобы спасти человека с острой кровопотерей: важнее восстановить объем крови, а то, что там носителей кислорода будет в разы меньше, чем в норме, лежащему под наркозом человеку не так страшно. Конечно, если потеря крови большая, то оставшиеся эритроциты перестанут обеспечивать организм кислородом, и тогда эту функцию тоже нужно корректировать.
– Одним из самых известных препаратов, который не только восстанавливал объем, но еще и переносил кислород, был советский перфторан.
– Начнем с того, что задача переноса кислорода, наверное, не самая критическая с точки зрения создания искусственных компонентов, потому что эритроциты – достаточно устойчивые клетки. Их можно отмыть от тромбоцитов, от плазмы крови и других компонентов, успешно криоконсервировать и хранить в замороженном виде. А это значит, что в целом для них возможна даже карантинизация – хранение до тех пор, пока донора несколько раз не протестируют и не убедятся, что он сдавал их будучи здоровым. А если создать нормальные условия с «кормлением» (добавлять питательные и антибактериальные вещества), то эритроциты даже без заморозки могут храниться почти месяц.
Поэтому ситуация с эритроцитами достаточно комфортабельная, и очень острой нужды в том, чтобы делать искусственные эритроциты, нет. Хотя, конечно, речь идет о больших городах и больших клиниках. При этом даже в Москве (да и по всему миру) количество доноров, к сожалению, падает. И нехватка эритроцитов особо остро проявляется, как только наступают тяжелые времена: пандемии, катастрофы, войны и так далее.
Возвращаясь к перфторанам, скажу, что так как у эритроцитов функция достаточно простая, то люди довольно рано начали экспериментировать с препаратами, которые связывают и переносят кислород. Перфтораны – это углеводороды, в которых все атомы водорода замещены на атомы фтора. Они способны растворять большое количество разных газов, включая кислород. Это отечественная разработка Института биофизики в городе Пущино, разработка с очень непростой судьбой. Я не являюсь специалистом в этой области и не работал с ними сам, но, насколько мне известно, механизм действия перфторанов является комплексным. Помимо улучшения переноса кислорода (которое само по себе было, по-видимому, недостаточно сильным для того, чтобы они полностью заменили эритроциты), и, возможно, не только кислорода, они также влияют на реологические параметры крови (то есть на ее текучесть), на состояние оставшихся у пациентов эритроцитов и на газообмен между ними и тканями.
Что такое перфторан
История советского, а затем российского перфторана более похожа на трагический фильм. Все началось во второй половине XX века, когда с Запада начали приходить сведения о создании жидкости, способной наполнить легкие живого организма, при этом его не убивая. «Мышь как рыба» – так называлась статья в журнале Nature, опубликованная в 1962 году американцем Килстрой. В Советском Союзе пытались повторить эксперимент, но ничего не вышло (собственно, никто до сих пор полностью успешно такую задумку не реализовал). Но работы начались, и вскоре в Институте биофизики АН СССР был разработан перфторан.
Сам по себе он не переносит кислород по кровеносному руслу. Действие перфторана основано на функции посредничества между оставшимися в теле эритроцитами и требующими кислорода тканями. Впервые эмульсию применили на восьмилетней девочке, которой до этого ввели неправильную группу крови. Чтобы избежать серьезных осложнений, было принято решение экстренно ввести ей перфторан, и, ко всеобщему изумлению, девочка выжила и быстро пошла на поправку. Наличие доступа к перфторану было заслугой профессора Феликса Белоярцева, который возглавлял лабораторию в условиях жесткого дефицита ресурсов и непосильного ограничения времени.
К сожалению, для всех героев – создателей отечественной «голубой крови» все закончилось не очень хорошо. Феликса Белоярцева довели до самоубийства спецслужбы, завод по производству перфторана много раз переходил из рук в руки, производство стояло. И, несмотря на многочисленные подтверждения эффективности препарата, в массовой серии увидеть его до сих пор невозможно.
Да, конечно, ходят истории про невероятную эффективность перфторана во времена войны в Афганистане, но пока в каждой аптечке такое средство не лежит. Ни российский перфторан, ни созданный в начале 1980-х японцами аналогичный препарат флуосол до сих пор не получили широкого распространения.
Мода на кроветворение захватывает множество органов, оно идет в селезенке, лимфатических узлах, тимусе (вилочковой железе), в костном мозге.
Сделай сам
– Если говорить о полностью искусственных компонентах, в какой области ученые продвинулись больше всего?
– Начну с другого конца: лейкоциты пока рассматриваются в последнюю очередь. И в силу своей сложности, и в силу ограниченности использования. Ведь речь идет о том, что человеку фактически создают искусственный иммунитет.
– Больше всего статей сегодня публикуется по созданию искусственных тромбоцитов.
– Да, это сегодня самый проблемный и при этом остро нужный компонент. Эти крохотные клетки устроены гораздо сложнее, чем те же эритроциты, потому что у них много разнообразных задач. Тромбоциты должны найти место повреждения, прикрепиться друг к другу, выработать вещества, чтобы активироваться и тем самым улучшить свертывание крови. Все это надо сделать без ошибки, так как если активироваться в ложном месте, то получится тромб, вызывающий инфаркт или ишемический инсульт. После этого тромбоциты сжимаются, что способствует стягиванию раны и уменьшению объема тромба.
Сейчас научились делать тромбоконцентраты: их выделяют из крови с помощью тромбоцитофереза. По итогам получается пакетик с препаратом, который живет всего пять-семь дней. Тромбоциты вообще очень капризные. Их нельзя класть в холодильник, потому что клетки активируются даже от легкого охлаждения, поэтому полученную массу при комнатной температуре кладут на мешалку и нежно качают. Тромбоциты можно подвергнуть процедуре вирусной инактивации, но она также может привести к ухудшению их состояния. Криоконсервирование тромбоцитов теоретически возможно, но настолько сложно, что с ним никто не связывается.
Из-за этих особенностей в клиниках зачастую возникает дефицит тромбоконцентратов. А переливать их нужно достаточно регулярно. Например, пациентам с коронавирусом, которые лежат на аппаратах искусственного дыхания, тромбоциты переливают очень часто. Потому что в этих аппаратах тромбоциты постоянно активируются, закрепляются на мембранах устройства и выводятся из кровотока. Если не переливать таким пациентам тромбоциты, то у них будут высокие риски кровоизлияния с тяжелыми последствиями. При других тяжелых состояниях также бывают ситуации, требующие переливания. Так что вопрос создания искусственных аналогов стоит очень остро. И именно здесь сегодня максимально сосредоточены усилия ученых.
– Какие пути тут наиболее перспективны?
– Один из способов – получение полноценных тромбоцитов из стволовых клеток.
Эта технология с каждым годом становится все более отлаженной. И если двадцать лет назад эксперименты в этом направлении были чем-то уникальным, то сегодня в мире есть множество групп, занятых чем-то подобным. В частности, у нас, в Центре имени Дмитрия Рогачева, в моей лаборатории такие работы ведет один из аспирантов.
– Как выглядит технология превращения?
– Нужно взять исходный клеточный материал, а затем с помощью особого коктейля веществ дифференцировать в клетки, которые нужны нам. В нашем случае мы используем клетки костного мозга. Они перерождаются в мегакариоциты, клетки, которые генерируют протромбоциты – предшественники тромбоцитов. То есть мы в лаборатории повторяем весь тот путь, который клетки проходят в организме. Есть и технологии, связанные с перепрограммированием клеток, позволяющие получать тромбоциты не из клеток костного мозга, а из каких-то иных.
– А чем отличаются полученные тромбоциты от естественных? Какие функции удается повторить, а какие нет?
– Пока кажется, что они получаются достаточно близкими к естественным. Поэтому здесь проблема исключительно в стоимости и производительности. Пока искусственные тромбоциты на многие порядки дороже по сравнению с концентратами, полученными из донорской крови.
– А что там самое дорогое в этом процессе? Вроде стволовые клетки перепрограммируют уже много лет…
– Основная проблема – низкий выход тромбоцитов. Любой реагент, который используется для «коктейля», в переводе на наши деньги стоит от 50 тысяч рублей до 200 тысяч рублей. Для контроля процесса на каждом этапе превращения клетки нужно метить реагентами, каждый из которых тоже стоит такие же суммы столько же… А на выходе, повторюсь, мы получаем в тысячи или сотни тысяч раз меньше клеток, чем в тромбоконцентратах. Для исследовательских целей работать с такими клетками можно (и то их не хватает), а вот использовать их для лечения пока слишком дорого.
– Какие еще есть пути создания искусственных тромбоцитов?
– Второе важнейшее направление в нашей области – чисто искусственные тромбоциты. Речь идет о конструкциях на основе нанокапсул и микровезикул, которые можно нагрузить лекарственными веществами.
Такие тромбоциты пока выглядят слабой версией настоящих, но они в ближайшей перспективе гораздо более реальны с точки зрения экономики и очень гибкие с точки зрения совершенствования и модификации.
– А что все-таки за основа у этих капсул?

– Некоторые исследователи берут обычные тромбоциты, например из просроченных тромбоконцентратов, и высушивают их под вакуумом, а перед переливанием разводят. Другие команды используют альбуминовые капсулы или просто наносферы диаметром 100–200–500 нанометров из белка (белок удобен тем, что он со временем разрушается), в которые вставляют дополнительные белки, чтобы эти капсулы крепились, куда нужно. Третий перспективный вариант – липидные везикулы, то есть липидные пузырьки, сделанные из очищенных липидов, опять же с вставленными белками. Есть и более сложные идеи, такие как «тромбоэритроциты» (технология, в которой у человека забирают эритроциты и наделяют некоторыми свойствами тромбоцитов, пришивая к ним белки, помогающие встраиваться в тромбоцитарные пробки). Сейчас эти подходы конкурируют друг с другом, но принципиально ситуация не меняется уже почти 20 лет: большая часть исследований так и не перевалила за вторую стадию клинических испытаний. Кстати, эта тема активно поддерживается военными, в том числе в Пентагоне, поскольку искусственные тромбоциты очень важны в чрезвычайных ситуациях и во время боевых действий. Но тем не менее пока все работы заканчиваются на первом этапе– то есть на испытаниях на животных.
Какие еще бывают искусственные тромбоциты
В данный момент ведутся разработки по созданию полностью искусственных кровяных пластинок – тромбоцитов, состоящих либо из смеси полимеров (исследователи из Калифорнийского университета в Санта-Барбаре (UCSB), Научно-исследовательского института Скриппса (TSRI) и Медицинского научно-исследовательского института Сэнфорда – Бернема – Пребиса (SBP) в Ла-Хойя, а также ученые из Западного резервного университета Кейза, CWRU) или белковых нанокапсул (Институт биологической инженерии Висса при Гарвардском университете, WIBIE). Кровотечение они остановить могут, но, к сожалению, ни те ни другие не содержат факторов роста и стимуляции регенерации тканей, в отличие от реальных тромбоцитов. Поэтому вскоре возможно появление искусственного тромбоцитарного порошка для применения в экстренных случаях. Другой подход – это создание реальных тромбоцитов из стволовых клеток. Но здесь все еще сложнее: стволовые клетки крайне нежны, прихотливы, работа с ними очень дорого стоит, и получать тромбоциты в промышленных масштабах из них до сих пор не умеют. Так что до развития этой технологии придется ждать и ждать, но в принципе она работает, как показывают японские ученые из Центра прикладных исследований iPS-клеток Университета Киото (CiRA).
– У нас в стране кто-то занимается конструированием полностью искусственных тромбоцитов?
– Насколько мне известно, команд, работающих на приличном уровне, у нас пока еще нет.
– А что нужно, на ваш взгляд, чтобы в этой области произошел какой-то прорыв? В чем основная проблема?
– Поскольку разработкой таких тромбоцитов обычно занимаются уже не чисто научные лаборатории, а стартапы, они редко публикуют результаты, тем более отрицательные. Поэтому о многом можно только догадываться.
Я сам думаю, что, перед тем как начинать делать искусственные тромбоциты, мы должны достаточно хорошо понять, как они работают в организме.
А с этим, на мой взгляд, пока еще большие проблемы. В этом плане мне, как и любому нормальному ученому, кажется, что правильный подход –тот, которым занимается наша команда: мы пытаемся понять смысл функций тромбоцитов. И надеемся, что именно это поможет сделать успешные искусственные компоненты.
– Какая самая интересная задача стоит перед вами в данный момент?
– Есть несколько проблем. Первая: мы плохо понимаем, как тромбоциты различают тромбоз и гемостаз. Грубо говоря, как они принимают решение, что нужно делать при обнаружении поврежденной ткани. Я напомню, что тромбоз – это когда тромбоциты (или система свертывания крови) делают пробку в сосуде и перекрывают движение крови по сосуду. То есть тромбоз – это как раз то, что вызывает инфаркты и инсульты. А гемостаз – это когда те же самые клетки выполняют свою нормальную задачу, делая пробку только в ране, в то время как движение крови по сосудам продолжается.
То есть правильно работающий тромбоцит должен понимать, что происходит вокруг, быстро срабатывать при ранениях и реализовывать гемостаз, но при этом не вызывать тромбоз.
То есть правильно работающий тромбоцит должен понимать, что происходит вокруг, быстро срабатывать при ранениях и реализовывать гемостаз, но при этом не вызывать тромбоз.
Эта задача интегральная. Чтобы в ней разобраться, нужно учитывать все этапы работы тромбоцитов, их взаимодействие со свертыванием крови, реологию, роль сосудистой стенки. Она максимально интересна для нашей команды и большого количества наших конкурентов по всему миру. Я подозреваю, что основная проблема всех существующих сегодня препаратов в том, что искусственные тромбоциты проводить это различие не умеют. Если человеку ввести такие клетки, то, скорее всего, у него действительно остановится кровотечение. А заодно во многих местах начнут образовываться тромбы. Пока мы не поймем, как система гемостаза разбирается, в каком месте быстро сделать пробку и как ее сделать правильного размера (точно по размеру раны и не залезая в здоровый сосуд), создание искусственных тромбоцитов будет оставаться игрой в русскую рулетку.
А зачем вообще нужна кровь?
Почему эволюция избрала такой путь развития и снабдила нас (и многих других существ) такой замечательной жидкостью
Путь эволюции был долог. Если вы одноклеточный организм, кровь вам не нужна по определению. Все необходимые вещества и кислород, если он вам необходим, вы получаете из внешней среды. Такая ситуация происходит, если вы однослойный колониальный организм. Каждая клеточка вашего тела обращена во внешнюю среду, и вы замечательно оттуда все поглощаете. Проблемы возникают тогда, когда вы начинаете увеличиваться в толщину.
Снабжение внутренних структур питательными веществами – нетривиальная задача.
Первое, что может прийти на ум, – это создать полость с жидкостью, омывающую внутренние ткани и приносящую им питательные вещества. Потом добавить туда клетки, выполняющие защитные и регенеративные функции, – если у вас есть внутренняя среда, значит, там может кто-то поселиться (бактерии, например), а зачем вам это надо? Так поступили многие беспозвоночные, и подобная технология в их реалиях вполне себе работает.
Новые проблемы возникают при дальнейшем увеличении размеров тела и повышении скорости обмена веществ. Тут только защитными клетками не обойтись, нужна система доставки кислорода. И эту проблему можно решить двумя путями: с помощью той же жидкости, переносящей питательные вещества, или с помощью специальных клеток. Первым путем пошли насекомые и изобрели гемолимфу. В ней растворены белки, переносящие кислород от трахей в ткани тела. Эта система имеет свои ограничения: вы не можете стать очень большим. Размер вашего тела будет ограничен глубиной залегания трахей, поскольку по-настоящему эффективных способов переноса кислорода у вас нет. Именно поэтому в каменноугольном периоде летали стрекозы с размахом крыльев в 75 см, а теперь уже так не получится: просто кислорода было больше (35% против сегодняшних 21%).
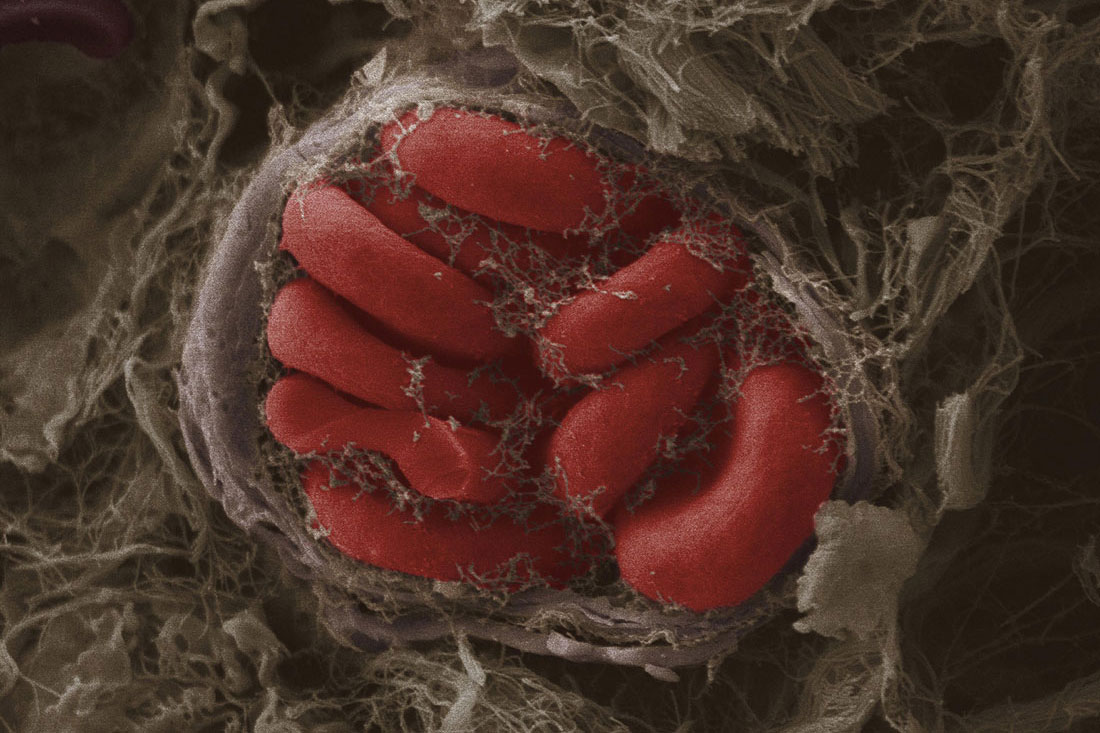
С появлением полноценных кислородпереносящих клеток все изменилось. В нашей крови этим занимаются двояковогнутые эритроциты, обеспечивающие эффективный транспорт необходимых газов в теле. Клетками защиты являются разнообразные лейкоциты, а защитную функцию выполняют тромбоциты. Здесь-то и начинается все самое интересное.
История крови
То, что кровь занимается чем-то важным, люди понимали испокон веков.
Считалось, что эта жидкость переносит абстрактную «жизненную силу», и поэтому пытались использовать кровь для продления жизни – в разных вариациях. Кровь человека и животных пили в чистом виде (о чем писали Гомер и Гиппократ), из нее делали смешанные напитки (такими вещами увлекался папа Иннокентий VIII), в ней купались (тут передаем привет древнегреческому царю Константину). Чаще всего использовалась кровь больших сильных животных, маленьких мальчиков и так далее – все, как завещает магическое мышление с его переносом свойств с помощью объектов.
Лишь в начале XVII века врачам и ученым стала открываться тайна функций крови.
Законы кровообращения сформулировал Уильям Гарвей в 1616 году, в 1661 году Марчелло Мальпиги дополнил и завершил теорию кровообращения открытием капилляров.
Учениками Гарвея сразу стали разрабатываться методы вливания разных веществ в кровь, а затем возник вопрос и о прямом переливании крови живым существам.
Первые успешные эксперименты были проделаны на собаках, затем таким же успехом завершились несколько переливаний крови от ягненка к человеку. Делалось это напрямую, и вскоре было запрещено: первые удачные опыты сменились серьезными побочными эффектами. Медики начали осознавать, что переливать кровь можно только от человека к человеку.
Бурные эксперименты по переливанию крови людям начались в XIX века, и этому способствовало развитие как инструментов, так и техник по взаимодействию с человеческим телом. Подбор доноров осуществлялся эмпирически, что приводило зачастую к непоправимым последствиям, но часть людей такие вливания спасали. Помимо экспериментов по переливанию крови медики изучали возможность переливать другие жидкости. Так, для лечения холеры предполагалось переливать раствор соды, для других заболеваний – молоко (разумеется, ни молоко, ни соду не стоит вливать в кровяное русло, на всякий случай напоминаем). 10 июля 1881 года Альберт Ландерер совершает грандиозное открытие, сопоставимое в медицинской науке с первым полетом человека в космос: он переливает человеку физиологический раствор поваренной соли, и эта практика стала основополагающей в технологиях трансфузиологии. Начинается XX век.
То, что кровь нельзя просто перелить от человека к человеку, сильно ограничивало процедуру и делало ее по-настоящему опасной. Только почему, оставалось загадкой до 1901 года, когда сотрудник Института патологической анатомии Венского университета Карл Ландштейнер опубликовал свою статью, описывающую различные группы крови. Оказалось, что на поверхности эритроцитов существуют целые комплексы белков, отвечающих за множество функций. На данный момент у человека обнаружено 36 систем групп крови, каждая из которых основана на соответствующих белках. Если переливать человеку кровь неправильной группы, то происходит мощный иммунный ответ, способный привести к смерти пациента. На данный момент в первую очередь обращают внимание на систему AB0 и резус-фактор, но и остальные системы не стоит списывать со счетов – несовместимость по ним также может привести к тяжелым последствиям.
Подготовили Елена Кудрявцева и Евгений Плисов
Фото крови: Anne Weston, Francis Crick Institute
Фото спикера: Михаила Анны Иванцовой