Алексей Каменский
Всем привет, кого не видно
Как иммунитет бактерий и вирусы спасают людей и почему иногда ломать гены полезнее, чем чинить
Получилось удачно. Павел Волчков, директор Института персонализированной медицины НМИЦ эндокринологии и Центра геномных технологий и биоинформатики МФТИ, сильно опоздал на нашу встречу. Поэтому он очень долго стеснялся сказать: «Все, извините, мне пора» — и вдобавок к основной истории, про получение стволовых клеток крови из обычных, рассказал еще одну — про хитрые способы генного редактирования. Не исключено, что со временем этот нарождающийся конкурент вытеснит трансплантацию костного мозга. Но, скорее всего, пара десятилетий у пересадки и связанных с ней регистров еще есть.
Трансплантация — это полная замена детали, которая плохо работает. Например, кроветворных клеток. Редактирование генома — это починка, причем на самом глубоком, базовом уровне, глубже уже некуда. Это исправление инструкций, по которым организм себя строит и работает.
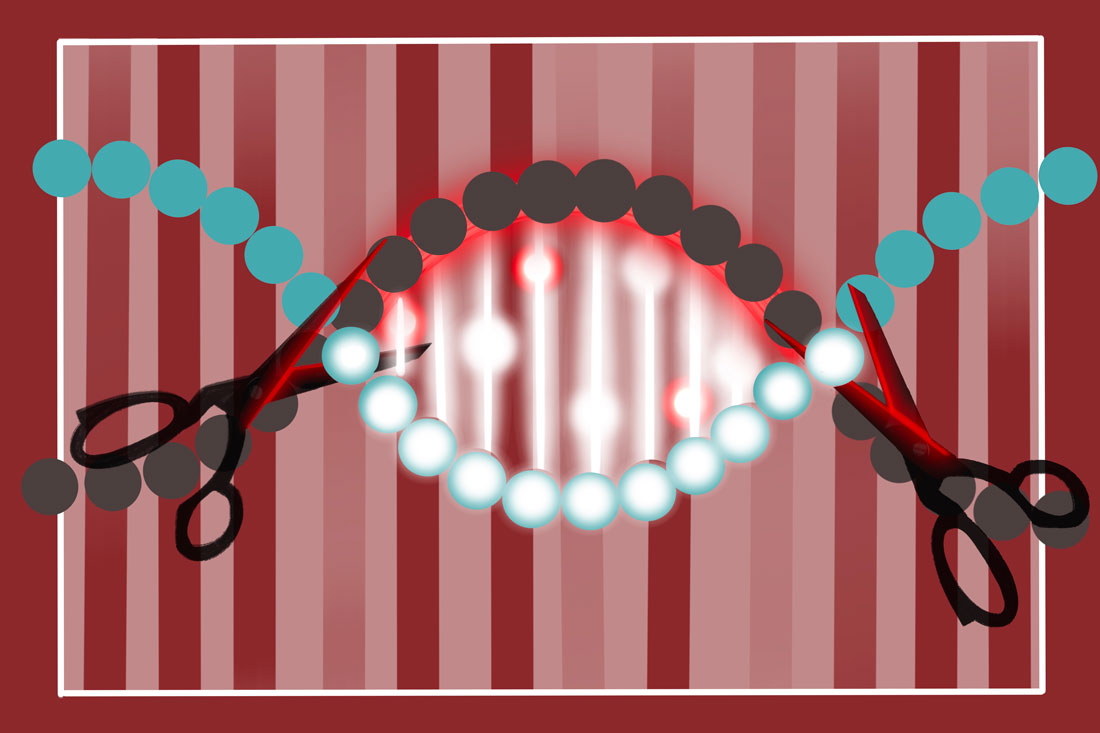
Чтобы разобраться, прежде чем передать слово Павлу Волчкову, пара слов про некрасивое и малопонятное название универсального метода такого редактирования — CRISPR-Cas. Если упрощенно: CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) — это короткие повторы, разделенные промежутками, а Cas (CRISPR-associated protein) — белок, «имеющий отношение» к этим повторам. И повторы, и белок находятся в геноме бактерий. Казалось бы, при чем тут редактирование нашей с вами ДНК?

Объясняет Павел Волчков:
Битый небитого везет
— CRISPR — это на самом деле адаптивный иммунитет бактерий. В их геноме есть такие участки — повторяющиеся бессмысленные последовательности генетических букв, между которыми вставлены уникальные, не повторяющиеся последовательности. И вот они-то как раз имеют смысл. Эти уникальные последовательности — кусочки генома вирусов, с которыми бактерии или ее предкам пришлось столкнуться. Она их таким образом запоминает, чтобы в следующий раз узнать и сразу начать бороться. Средство борьбы — белок Cas. А CRISPR помогает ему узнать элементы чужой ДНК, которые бактерия запомнила.
Для редактирования человеческой ДНК мы берем небольшую часть этого механизма — тот самый белок. Если быть точным, это не белок, а гибрид. Белковая машина. У нее есть режущая часть, белок, и надстройка из РНК, которая определяет, что резать. Эту надстройку мы можем создавать искусственно, чтобы машина резала тот ген, который нам нужно.
Как доставить этот механизм в человеческую клетку? Для этого мы используем вирусы.
Интересный получается сюжет, как в сказке: машину, созданную бактериями для борьбы с вирусами, везут на себе вирусы.
Для доставки используются разные вирусы. Например, аденовирус. Он большой и вызывает сильный иммунный ответ. Поэтому его хорошо использовать не для редактирования, а для вакцинации. Но реакция на такой вирус-доставщик может оказаться слишком сильной, возникнет всем известный цитокиновый шторм. Используются и аденоассоциированные вирусы, более мелкие. Тут другая опасность. Возможно, организм с этим вирусом уже знаком, ваши иммунные клетки его сразу распознают и будут подавлять доставку. Значит, понадобится сильная иммуносупрессия.
Золгенсма, генный препарат от СМА (спинальной мышечной атрофии. — Кровь5) — его разработала компания AveXis, которую затем купил Novartis, — как раз использует в качестве транспорта аденоассоциированный вирус. Novartis делает и офтальмологический генный препарат с таким же транспортом. И в обоих случаях приходится использовать иммуносупрессию.
Но есть еще одно направление, мы им занимаемся: синтетические вирусы для доставки. Их можно построить таким образом, чтобы они обходили иммунитет.
Семь раз отрежь
«Генетические ножницы» CRISPR-Cas первого поколения, самые простые, разрезают двойную цепочку ДНК в заданном месте. Наверное, лучше даже сказать не разрезают, а вырезают, уничтожают указанный им участок. Что там у вас написано на листочке — «Павел Юрьевич Волчков»? Если бы это была последовательность генетических букв, мы могли бы, например, с помощью такого механизма вырезать слово «Юрьевич».
Клеточные механизмы сразу же пытаются исправить повреждение. Это называется «репарация». Мы можем задать два пути такой репарации. Один — когда клетка пытается все восстановить в прежнем виде. Для ремонта поврежденного участка она берет за образец такой же участок гомологичной хромосомы: у нас, как вы помните, во всех клетках, кроме половых, их двойной набор. Так что если мы вырезали бракованный ген, вместо него, по идее, может встроиться здоровый. Но чаще используется иная схема: например, концы можно соединить между собой, ничего не встраивая, просто удалить ген.
Можно сделать ножницы, которые будут разрезать ДНК сразу в нескольких местах. Но все равно это технология первого поколения.
Второе поколение, основанное на той же CRISPR, — это уже не ножницы, а бэйс-эдитор (от base-editing — редактирование оснований. — Кровь5).

Он может точечно без разрезания заменять одну генетическую букву другой. Еще более продвинутая вещь — прайм-эдитор (от prime-editing — праймированное редактирование. — Кровь5). Он позволяет переписать сразу целый участок ДНК.
Ломать не строить
На самом деле все определяется конкретной терапевтической задачей. Я вам сейчас приведу удивительный пример. В Детской больнице Бостона я работал со Стюартом Оркином, исследователем в сфере гематологии и онкологии. Очень классный, динамичный, хоть и старенький уже.
У него было много пациентов с серповидноклеточной анемией и бета-талассемией. Это тяжелые врожденные заболевания, связанные с поломкой генов, кодирующих гемоглобин. Оркин заметил удивительный факт: часть пациентов болели бессимптомно. У них были мутации, которые должны были бы привести к заболеванию, однако проявлений не было. Он набрал когорту подобных людей и начал искать, что с ними не так. Оказалось, у части из них в дополнение к «основной» мутации была еще одна.
Суть вот в чем. Белковые молекулы имеют, так сказать, форму: они в зависимости от своего состава по-разному скручиваются. При серповидноклеточной анемии гемоглобин скручивается неправильно — он превращается в длинную колбасу. А эритроциты с таким гемоглобином растягиваются, приобретают серповидную форму. Такие эритроциты малофункциональные и короткоживущие. Болезнь проявляется не с рождения, потому что сначала кроветворные клетки компенсируют недостачу, ускоряя производство эритроцитов. Но их ресурс не бесконечен, он исчерпывается.
А что же с бессимптомными больными? У них из-за еще одной генетической поломки во взрослом состоянии продолжает синтезироваться фетальная форма гемоглобина, которая в норме есть только у человеческого зародыша. И она работает. Немного не так, как это должно быть у взрослого человека, но работает.
Эта компенсирующая мутация особенно часто встречается в районах с малярией. Ведь серповидноклеточная анемия, как известно, уменьшает риск малярии, у таких людей больше шансов не заболеть. А вторая мутация позволяет выжить тем, кто благодаря серповидноклеточной анемии спасся от малярии. Вот такой двойной естественный отбор.
Получается, у нас два пути: или пытаться исправить гены гемоглобина — это сложно. Или сломать в ДНК тот участок, который мешает производству фетального гемоглобина у взрослых.
Сейчас эта схема в стадии клинических исследований. Сложная, нетиповая схема лечения, но тривиальных путей в этой области нет. Для каждого заболевания свой путь. Взять упоминавшийся препарат от СМА: там в клетку доставляется бактериальная ДНК, которая никуда не встраивается, а живет и производит нужные белки независимо от человеческой ДНК.
Гены и деньги
Все это давно уже не только наука, и Novartis с его супердорогой золгенсмой не исключение. В Бостоне с нами работал, например, Боб Лангер, известнейший ученый и венчурный капиталист. Он один из инвесторов компании Moderna, которая сейчас стоит 70 млрд долларов. И это одна из сотни компаний, в которых он принимал участие. Он миллиардер.
Редактированием генома серьезно занимается CRISPR Therapeutics и еще целый ряд компаний. Но что и когда у них получится, невозможно предсказать. Кто бы мог предсказать лет пять назад, что Moderna будет столько стоить. Я думаю, допиливание технологий займет лет 10–15. А может, и больше: вдруг деньги закончатся и никто больше не захочет инвестировать?
Так что регистры потенциальных доноров еще долго будут нужны.
Если представить себе, что в них вступило все население земного шара, донора для любого пациента можно было бы найти немедленно, по щелчку пальцев, какой бы у него ни был редкий генотип. Но ведь трансплантацию нельзя считать универсальным средством на все времена. Миелоабляция, уничтожение костного мозга реципиента, — очень травматичная процедура. Вместе с кроветворными клетками умирают многие другие. Другое дело — таргетная миелоабляция, которая убивала бы только кроветворные клетки. Такая технология тоже есть — в лаборатории Ирвинга Вайсмана в Стэнфордском университете. Пока работает на мышах.
Фото: Надежда Храмова