Алексей Каменский
Все течет
Как люди постепенно понимали, что кровь у всех разная

Еще недавно считалось, что бывают совместимые группы крови и универсальные доноры, теперь это устаревшие понятия. С первого успешного переливания крови прошло всего 200 лет, и за это время врачи, задавая все новые вопросы, много раз пересматривали взгляды на эту процедуру. Мы составили краткую хронологию.
XVII–XVIII века: вопросов нет
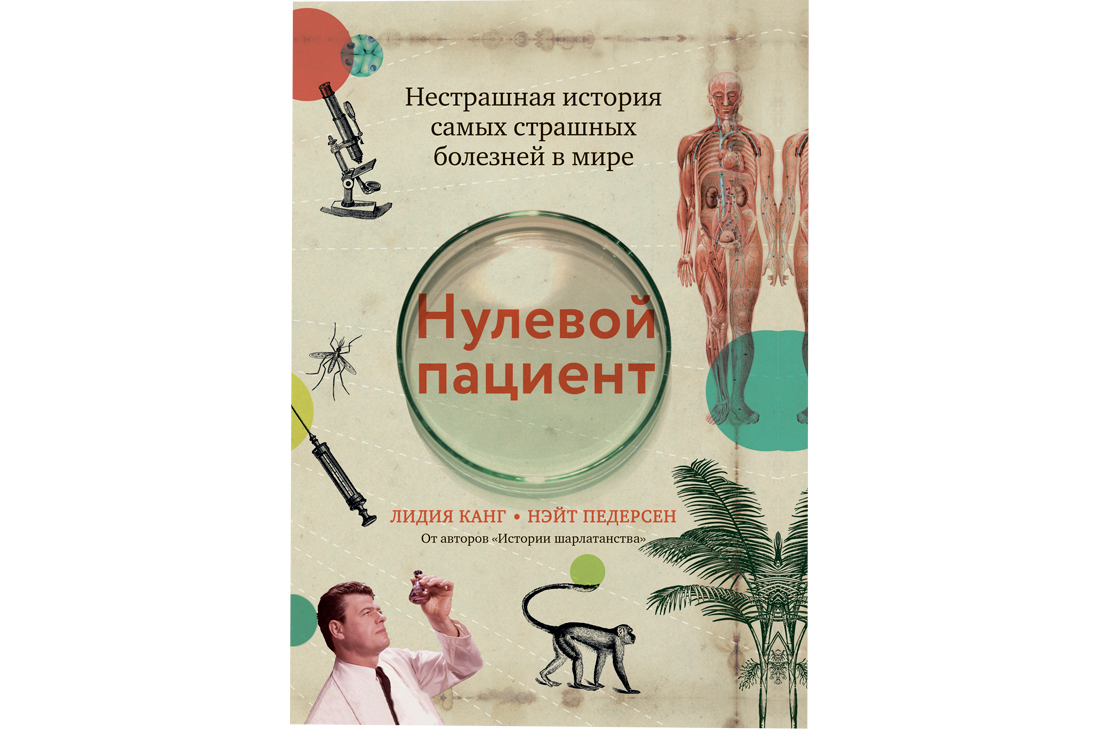
Удивительно, что историю кровопускания можно мерить тысячелетиями, а вот обратным процессом, «доливанием», врачи начали регулярно заниматься только в XVII веке. До этого даже правильных вопросов, ответы на которые помогли бы понять, как все работает, у исследователей не возникало. Систему кровообращения открыли совсем недавно, понимание, что это такое, еще не утвердилось в умах.
Кровь нередко пытались вливать через рот, надеясь, что дальше организм сам разберется и направит ее, куда нужно.
В качестве доноров использовали домашних животных – так проще. Проблема была в том, что некоторые пациенты все-таки выживали после такого лечения – то ли из-за малого количества перелитой крови, то ли из-за слишком краткого периода послеоперационного наблюдения. Поэтому, чтобы понять, что так все-таки нельзя, медикам понадобилось больше столетия.

XIX век: откуда осадок?
Первое удачное переливание от человека человеку проделал английский акушер Джеймс Бланделл. В своей работе он часто сталкивался с кровотечениями, размышлял, как бороться с потерей крови, и после многочисленных экспериментов на животных решился перейти на людей. В 1818 году он перелил женщине с послеродовым кровотечением четыре унции (примерно полстакана) крови ее мужа. Все прошло хорошо, Бланделл продолжил эксперименты, а затем опубликовал отчет о них в тогда еще молодом, но уже уважаемом журнале The Lancet. Из десяти переливаний успешно закончилось пять. Эта пропорция не сильно менялась весь XIX век – технология трансфузий совершенствовалась, но все равно удачи как-то уж слишком часто чередовались с провалами.
Только в 1900 году австриец Карл Ландштейнер нашел отгадку. Он обнаружил, что в некоторых случаях при «смешении кровей» разных людей выпадает осадок.
А затем, смешивая уже не цельную кровь, а ее составные элементы, сумел объяснить этот феномен.
Про четыре группы крови, которые за пределами России называют системой AB0, все, наверно, и так знают. Поэтому объясним их механизм кратко. На поверхности каждого из триллионов человеческих эритроцитов присутствуют сотни антигенов – веществ, которые могут при определенных условиях вызвать иммунный ответ: в плазме крови возникнут антитела – специальные белки, которые свяжут эти антигены.
Группу крови определяют два антигена на эритроцитах – A и B. Если присутствуют оба, это группа AB – в русской традиции четвертая. Таких людей раньше называли универсальными реципиентами. Если только A – вторая, только B – третья, а если ни A, ни B – первая, она же кровь универсального донора. Почему? В плазме крови есть антитела к тем антигенам, которых нет на эритроцитах. То есть у плазмы первой группы это антитела a и b, у второй – антитело b, у третьей – a, а у четвертой – ни одного. Если человеку с первой группой крови влить четвертую, антитела в его плазме соединятся с антигенами на эритроцитах перелитой ему крови, эритроциты слипнутся и выпадут в осадок. А у эритроцитов первой группы антигенов A и B нет, поэтому их можно переливать кому угодно.
На первый взгляд что-то в этой истории не сходится. Ведь все симметрично – у первой группы «хорошие», вообще без антигенов, эритроциты, зато «плохая» плазма.
В ней есть антитела a и b, которые должны вступить в реакцию с антигенами на эритроцитах реципиента, если у него кровь другой группы. Этого не происходит, объясняет заведующая зональной лабораторией иммунотипирования тканей Челябинской областной станции переливания крови Татьяна Суслова, потому что плазма донора смешивается с плазмой реципиента, титр (концентрация) антител понижается и становится неопасным для эритроцитов.
Более концептуальный вопрос – зачем вообще, помимо причинения головной боли трансфузиологам, нам нужны антигены A и B. В отличие от антигенов тканевой совместимости, они не были задуманы природой для различения «свой-чужой»: смешивания крови в природе не происходит. Но они важны для выживания человечества в целом: если люди разные, патогенам сложнее убить всех сразу.
Восприимчивость к заболеваниям зависит от группы крови. Например, у первой группы выше риск заболеть холерой. Для второй опаснее оспа. Для третьей – гонорея, туберкулез, сальмонеллез. Для четвертой – то же, но без гонореи.
1930-е годы: почему мать конфликтует с плодом?
В Первую мировую знания о группах крови вошли в жизнь: кровь раненым переливали много, не всегда удачно, но врачам было не до тонкостей. В мирные годы стало понятно, что в системе четырех групп крови чего-то не хватает. Врачи наблюдали несовместимость донора и реципиента, от AB0 не зависящую. Причем при повторном переливании от того же донора несовместимость усиливались. И вот так у Карла Ландштейнера, к тому времени уже нобелевского лауреата, появилась возможность еще раз отметиться в истории трансфузиологии. В 1940 году он вместе с соавтором опубликовал работу о еще одном антигене на человеческих эритроцитах. Его назвали резус-фактор, потому что тогда считалось, что у человека он такой же, как у макак-резусов. Позже выяснилось, что нет, но название все равно осталось.

Резус-фактор – это целая группа антигенов на поверхности эритроцитов, самый важный из которых – антиген под названием D. У большинства людей он есть. В Европе и Северной Америке резус-положительно 84–85% населения. А в Китае, Японии, Корее – больше 99%.
С резусом все немножко не так, как с группами крови. Антител к антигену D в крови у резус-отрицательного человека изначально нет. Но как только в нее попадают эритроциты с антигеном D, антитела к нему немедленно начинают образовываться.
По сути у бедняги возникает иммунитет к резус-положительным эритроцитам: если они попадут в его кровь снова, реакция на них будет быстрая и сильная. Этим объясняются проблемы резус-отрицательных матерей, вынашивающих резус-положительный плод: первая беременность может пройти без проблем, а при второй антитела матери могут создать опасность для жизни ребенка.
1950-е: почему лейкоциты тоже склеиваются?
Эту историю Кровь5 уже рассказывала: французский ученый Жан Доссе, в годы Второй мировой много занимавшийся переливанием крови, заметил, что слипаться могут не только эритроциты, но и лейкоциты – белые кровяные тельца.
Причем тут «память крови» была особенно сильна: чем больше человеку делали переливаний, тем хуже вели себя лейкоциты.
Оказалось, на их поверхности тоже есть раздражающие иммунную систему антигены – по месту обнаружения их назвали «человеческие лейкоцитарные антигены» (Human Leukocyte Antigens, HLA). На самом деле HLA – не приоритет лейкоцитов. Они есть на каждой клетке человеческого организма за одним исключением, о котором ниже. Это антигены тканевой совместимости – те самые, совпадение которых так важно при трансплантации костного мозга. Проще говоря, метки, с помощью которых клетки сообщают иммунной системе, что они свои, родные.
Чем больше переливаний, тем больше в крови реципиента антител против чужих HLA, тем хуже он переносит процедуру. Как быть?
Подбирать донора крови по HLA нереально: совпадения слишком редки, а донорская кровь нужна слишком часто. Выход – переливать не кровь, а отдельные ее компоненты.
Ведь на эритроцитах – единственных среди всех клеток организма – антигенов HLA нет.
Со второй половины XX века ход событий в трансфузиологии так ускорился, что расставить их в хронологическом порядке просто невозможно. Научные открытия переплетались с технологическими. В 1970-х стал развиваться аферез – разделение крови на компоненты, и переливание цельной крови постепенно ушло в прошлое. Быстро распространялось донорство: теперь можно было выбирать из разных «кровей» самую подходящую, и понятие совместимых групп стало отмирать. Зачем что-то совмещать, если можно подобрать донора с той же группой крови.
Само понятие «группа крови» изменилось. Помимо AB0 и резус-фактора появилось еще около четырех десятков классификаций крови по составу антигенов на эритроцитах. Но самые важные – по-прежнему AB0 и резус. Остальные антигены, по словам Сусловой, обычно «слишком слабенькие, чтобы вызвать иммунную реакцию». Но если это случается, для таких больных приходится проверять кровь и на эти антигены.
Третьи по силе после двух лидеров – антигены системы Kell, названной в честь женщины по фамилии Келлахер, у которой они были впервые обнаружены (больше она ничем не прославилась). «Kell-положительность» проявляется очень необычно: люди с таким антигеном ощущают горечь вещества под названием фенилтиокарбамид, в то время как остальным людям оно кажется безвкусным. «93% людей Kell-отрицательны, – говорит Суслова. – Поэтому редких Kell-положительных доноров используют ограниченно, чтобы не вызвать иммунную реакцию у Kell-отрицательных реципиентов».
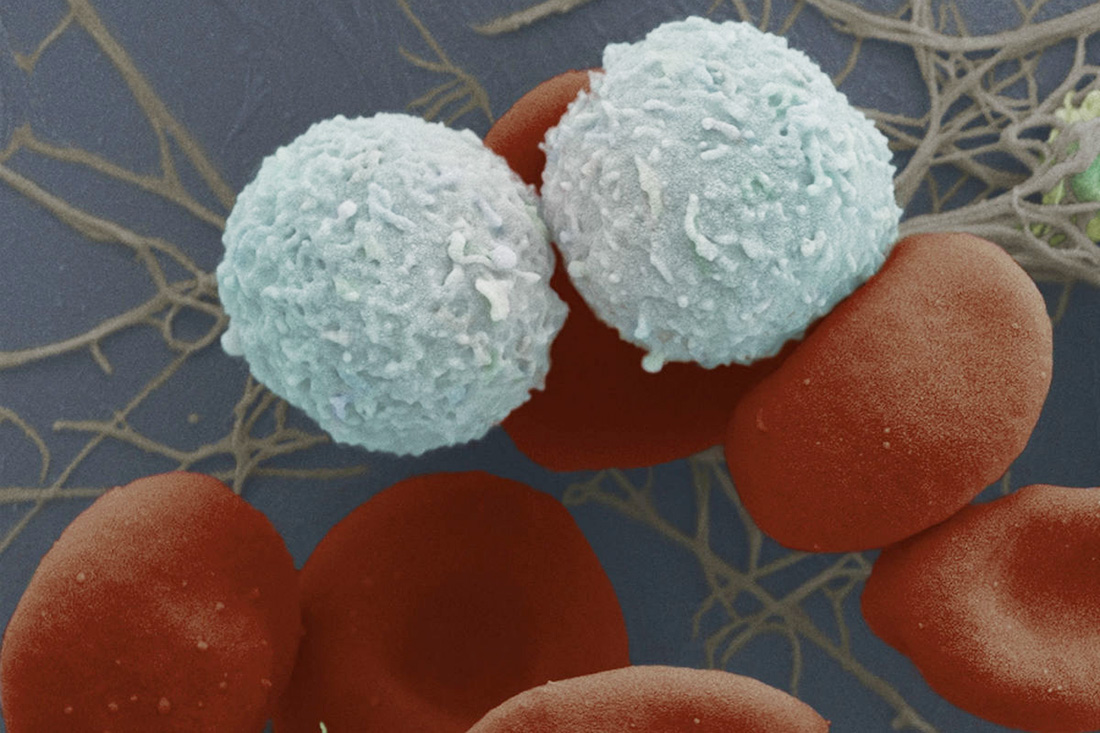
Часть лучше целого?
Все четыре компонента крови – плазму, эритроциты, лейкоциты и тромбоциты – сейчас используют по отдельности. Как?
Тяжелее всего иметь дело с лейкоцитами: извлеченные из крови, они живут не больше суток.
Но их и переливают редко: есть много препаратов, помогающих больному наладить собственное производство этих клеток. «Лейкомасса очень иммуногенна, уже через одно-два переливания у человека вырабатываются антитела», – рассказывает Суслова. Главное, что может потребоваться пациенту, – нейтрофилы, один из видов лейкоцитов. Эти клетки первыми прибывают в место проникновения инфекции. Их переливание может ненадолго восстановить иммунитет больного.
Проще всего хранить плазму, говорит Суслова: достаточно заморозить ее до -40 °С. С клетками всегда сложнее. Эритроциты внутри человеческого организма живут около четырех месяцев, но срок их годности при переливании – всего три недели. Причем держать их надо в холодильнике. Тромбоциты – еще более нежные создания. Их хранят, объясняет Суслова, в специальных инкубаторах при температуре 22–24 °С и с постоянным перемешиванием, чтобы они не склеились. Но даже в самых лучших условиях они могут прожить всего 5–7 дней.
«Тромбоциты маленькие, – говорит Суслова. – На их поверхности помещается меньше антигенов, поэтому они не так иммуногенны, как эритроциты».
Антигенов резус-фактора на тромбоцитах нет, но антигены AB0 присутствуют, поэтому тромбоциты той же группы крови лучше себя чувствуют при трансфузии и самих трансфузий может потребоваться меньше.
Переливать тромбоциты одному и тому же человеку обычно приходится много раз – слишком короток их век. Так что, хоть они и маленькие, постепенно у реципиента образуются антитела к их антигенам. Дело может кончиться так называемой рефрактерностью – иммунитетом ко всем вообще «пришлым» тромбоцитам. Их переливают, а количество в крови не растет. Трансфузиологам явно есть над чем еще поработать.
О совместимости костного мозга и других органов человека читайте в материале «Чужой среди своих»