Елена Бабичева
Клетка всемогущая: какие возможности для лечения открывает плюрипотентность
Гемопоэтические стволовые клетки отвечают в организме за кроветворение, давая начало лейкоцитам, тромбоцитам, эритроцитам… А что такое плюрипотентные стволовые клетки и на что они способны, разбиралась Кровь5.
На самой ранней, зародышевой, стадии эмбриональные клетки не имеют конкретной специализации и могут развиться практически в какие угодно. Эта их особенность создает широкие возможности для моделирования того, как развиваются болезни, а следовательно, и разработки более эффективного их лечения.
Сила неопределившихся
Это свойство эмбриональных клеток давать начало клеткам всех типов в организме называется плюрипотентностью. Сохраняется оно недолго, всего лишь одиннадцать дней — с момента оплодотворения яйцеклетки и до имплантации зародыша в стенку матки.
Все это время идет активный процесс самообновления: эмбриональные стволовые клетки (ЭСК) могут бесконечно делиться, производя дочерние, сохраняющие те же свойства клетки-предшественника. Чтобы затем, получив определенный сигнал, выйти из режима самообновления и включить программу, ведущую к дифференцировке в специализированные типы клеток, превратившись уже в мультипотентные, которые размножаются в одном выбранном направлении, чтобы «растить» конкретный орган.
Однако пока эмбриональная стволовая клетка «раздумывает», в какую будет развиваться, она обладает соблазнительным потенциалом для ученых.

Являясь родоначальницей специализированных клеток, она может использоваться для создания гемопоэтических клеток, нейронов, гепатоцитов и кардиомиоцитов, то есть клеток печени и сердца, и др. И далее применяться для изучения и лечения заболеваний, для создания новых лекарств.
Спорные источники
В 1981 году эмбриональные стволовые клетки были впервые выделены из мышиной бластоцисты — части, которая дает начало эмбриону. Человеческие ЭСК были получены значительно позже, только в 1998-м, путем экстракорпорального оплодотворения (ЭКО). Создание линий человеческих ЭСК показало, что они могут неограниченно расти in vitro (в пробирке), сохраняя свой кариотип и плюрипотентность. Их потенциал развития для дифференцировки во все типы клеток организма был подтвержден несколькими анализами in vitro и in vivo (на живой ткани).
Но встала серьезная этическая проблема. Ведь стволовые клетки не просто обладают плюрипотентным свойством на эмбриональном этапе. По сути одиннадцатидневный эмбрион — не что иное, как скопление этих самых клеток. Таким образом, их можно получить, лишь разрушив его. Сторонники таких исследований упирали на то, что для выделения плюрипотентных клеток используются эмбрионы, полученные с помощью ЭКО и никем не востребованные, которые все равно утилизируют.
Разрешить биоэтическую дилемму попытались ученые Гарвардской медицинской школы, предложив получать ЭСК методом химеризации. Для этого соматические клетки человеческого плода соединили с коровьей яйцеклеткой, из которой предварительно удалили ядро (пронуклеус). Таким образом были получены гибридные бластоцисты, а уже из них — эмбриональные стволовые клетки.
С одной стороны, данный метод позволял избежать использования человеческого эмбриона и связанного с этим биоэтического конфликта. С другой — порождал новые вопросы, ведь это был межвидовой зародыш.
Неизвестно, какая у него генетика, насколько он жизнеспособный, а риск передачи таким образом зоонозных инфекций (от животных человеку) достаточно велик.

Несмотря на эти риски и жаркие научные дискуссии об этичности подобных исследований, в 2000 году Австралия, Япония и Великобритания отменили мораторий на такие эксперименты и разрешили работу над созданием межвидовых гибридов.
Точку в дискуссии обозначили японские ученые.
Коктейль Яманаки
В 2012 году Нобелевская премия по физиологии и медицине была вручена Джону Бертрану Гёрдону, профессору Кембриджского университета и руководителю Института Гердона, и Синъе Яманаке, профессору Университета Киото и Института Гладстона. Их наградили за открытие возможности перепрограммирования соматических клеток в плюрипотентные.
Справедливости ради надо отметить, что первые опыты по перепрограммированию соматических клеток в плюрипотентные путем переноса ядра были проведены гораздо раньше, еще в начале 1960-х, когда будущий нобелевский лауреат Яманака только родился. Однако лишь спустя почти четыре десятилетия, в 2006 году, он вместе с коллегой Кацутоси Такахаси сумел идентифицировать гены, которые, собственно, и запускали процесс репрограммирования фибробластов кожи мыши в плюрипотентные клетки.
«Коктейль Яманаки» — такое название получила совокупность четырех генов Oct4, Sox2, Klf4 и c-Myc (OSKM), которые достаточно ввести в любые взрослые клетки, чтобы спустя месяц они ничем бы не отличались от эмбриональных, то есть стали бы плюрипотентными.
Потом подобный эксперимент был проведен с использованием фибробластов человека. Перепрограммированные клетки получили название «индуцированные плюрипотентные стволовые клетки» (иПСК).
Многочисленные эксперименты подтвердили, что плюрипотентность достигается скоординированными действиями этих генов с множественными сигнальными путями, дающими ответ на определенные условия окружающей среды. У ЭСК такое состояние сохраняется те самые одиннадцать дней до момента гаструляции — сложного процесса морфогенетических изменений, при котором начинается дифференцировка клеток, дающих начало различным тканям и органам. На этом этапе уровни транскрипционных факторов снижаются, и клетки теряют свои плюрипотентные свойства. У иПСК «срок действия» плюрипотентности неограничен.
Получая Нобелевскую премию, Яманака призвал ученых отказаться от использования эмбриональных клеток. Ведь плюрипотентные клетки, полученные искусственным путем, имеют те же характеристики, что и эмбриональные, но при этом не провоцируют биоэтический конфликт.
Уравнение с неизвестными
Впрочем, дальнейшие исследования по перепрограммированию мышиных и человеческих стволовых клеток показали, что не все так просто с ними. Эксперименты подтверждали, что данная методология применима практически для всех соматических клеток, а иПСК потенциально могут обеспечить получение неограниченного количества аутологичных клеток для разных нужд медицины.
При этом эффективность перепрограммирования пока еще крайне низка: плюрипотентными становятся менее 1% соматических клеток.
Не определен пока как долгосрочный эффект, так и риски их применения. Все же взрослые соматические клетки, из которых получают плюрипотентные, за время жизни накапливают в своих геномах различные изменения. Как они отразятся на перепрограммируемых, вопрос открытый. Высказываются опасения, что перепрограммирование может активировать развитие опухолей.
Не все однозначно и с иммунной совместимостью с клетками пациента. Ряд исследований показал, что клетки, полученные из индуцированных плюрипотентных клеток, могут вызывать отторжение при трансплантации. Нельзя исключать и риск присутствия клеток нежелательного типа в клеточном трансплантате.
В общем пока применение иПСК — уравнение со многими неизвестными, которое ученым еще только предстоит решить.
Потенциал без границ?
Вместе с тем потенциал плюрипотентных клеток огромен. Речь не только про их способность дифференцироваться в определенные типы клеток, но и про клиническое применение. В первую очередь их использование имеет большие перспективы в регенеративной медицине.
Сейчас сразу несколько научных институтов в США и Японии ведут работы по дифференцировке ПСК в пигментный эпителий сетчатки. Его повреждение является проявлением многих дегенеративных заболеваний сетчатки глаза, в том числе возрастной макулярной дегенерации. Это прогрессирующее глазное заболевание, которое приводит к снижению остроты зрения за счет поражения центрального отдела сетчатки глаза — макулы. Применение иПСК позволит замедлить развитие патологии и даже вернуть зрение. Кровь5 рассказывала о таких экспериментах.
Клетки, полученные из иПСК, также используются в клинических испытаниях иммунотерапии рака для лечения опухолей на поздних стадиях.
Несколько лет назад было одобрено клиническое исследование кардиомиоцитов, полученных из иПСК, для лечения сердечных заболеваний.
Помимо использования в регенеративной медицине для лечения поврежденных тканей с помощью клеточно-заместительной терапии иПСК используют для моделирования заболеваний, например нейродегенеративных. Чтобы понять, что происходит в организме при болезни Альцгеймера или Паркинсона, нужно исследовать нейроны. Но от пациента их получить весьма затруднительно. Зато их можно вырастить, причем уже с патологией.
Для этого надо получить клетки кожи у пациента с соответствующим заболеванием. Эти клетки подвергают репрограммированию с помощью того самого «коктейля Яманаки», в результате чего получают плюрипотентные клетки. Затем их дифференцируют в специализированные, в данном случае в нейронные, и получают необходимый материал для исследования.
Первое клиническое испытание по лечению болезни Паркинсона с использованием нейронов, полученных из иПСК, было проведено в 2018 году в Университете Киото.
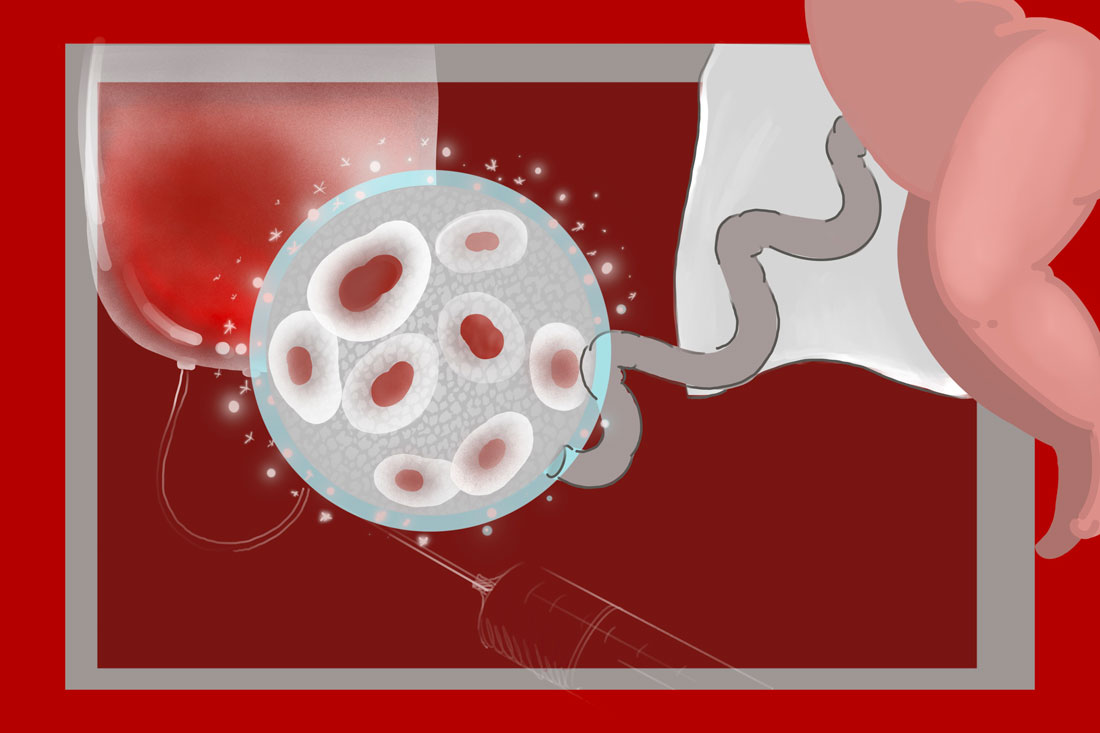
Еще одно перспективное направление — возможность редактировать геном иПСК и возвращать пациенту уже исправленные клетки. Первые шаги в этой области уже ведутся: исследователи попытались исправить мутацию, отвечающую за серповидноклеточную анемию. С помощью технологии геномного редактирования они изменяли стволовые клетки костного мозга и обратно вводили отредактированные. Гипотетически вместо стволовых клеток можно использовать индуцированные плюрипотентные.
Перспективы применения иПСК, в общем, захватывающие.