Анастасия Павлова
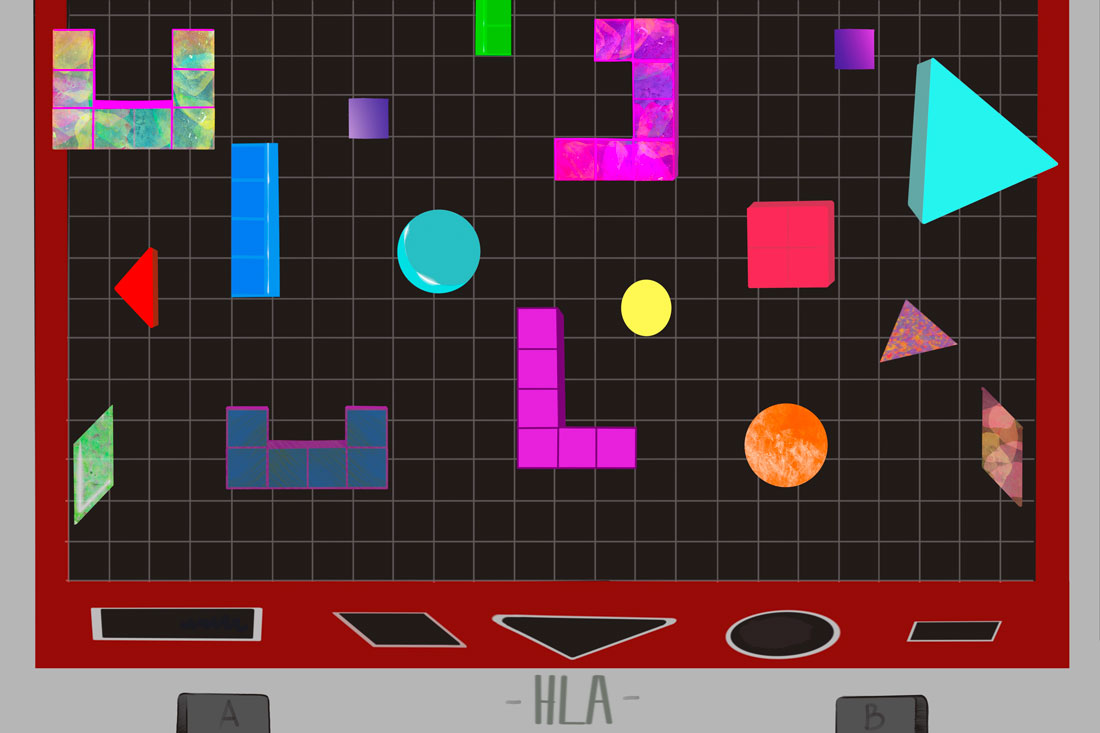
Зачем иммунитет играет в тетрис
Гены тканевой совместимости чрезвычайно разнообразны, из-за этого так сложно подобрать совпадающих донора и реципиента. Но в нашем организме ничего не бывает просто так. Мы предлагаем взглянуть на эту особую часть нашего генома с более позитивной точки зрения и попытаемся на уровне молекулярной биологии объяснить, как она помогает нам бороться с инфекциями.
Те, кто сталкивался с темой трансплантации костного мозга, наверняка слышали такие термины, как «генотипирование HLA», «полное совпадение по HLA» и т. д. HLA (Human Leukocyte Antigens) — это «человеческий» синоним генов главного комплекса гистосовместимости. Приставка «гисто-» означает ткань, то есть уже само название отсылает к сфере трансплантологии. И в этом нет ничего удивительного, поскольку изначально данная группа генов была открыта в середине XX века американским биологом Джорджем Снеллом, изучавшим факторы, влияющие на приживление и отторжение пересаженных тканей у мышей. Чуть позже похожие гены нашли и у людей.
Насколько HLA разнообразны?
HLA — это группа генов, которые делятся на два класса: первый, в свою очередь, подразделяется на гены A, B, C и некоторые другие, а второй — на DP, DQ, DR и прочие. Есть еще третья группа, но функционально она отвечает за совершенно другую область иммунитета.
Отличительной особенностью HLA является их чрезвычайное разнообразие, или, по-научному, полиморфизм, внутри каждого такого гена. Обычно, если ген полиморфный, то он насчитывает два-три варианта (аллеля): например, один аллель «кодирует» прямые волосы, другой — кудрявые, а их сочетание может давать волнистые. У генов же HLA таких вариантов (аллелей) тысячи! Например, у HLA-A их описано почти 7 тысяч, а у HLA-B — больше 8 тысяч! Называть здесь точные цифры (взятые из базы данных IMGT, Международной информационной системы иммуногенетики) не имеет смысла, потому что каждый месяц открывают все новые и новые варианты, и если вы будете читать эту статью через полгода, данные уже устареют.
Из-за таких генетических расхождений донорские и реципиентские клетки кажутся друг другу чужими. Поэтому в случае трансплантации органов иммунитет нового хозяина начинает атаковать пересаженные ткани. А при пересадке костного мозга уже произведенные им иммунные клетки атакуют организм хозяина.
Возникает вопрос в стиле Маяковского: «Послушайте! Ведь если эти гены полиморфны, значит, это кому-нибудь нужно? Значит, кто-то хочет, чтобы они различались?» Очевидно, что эволюция не думала о проблемах такого недавно существующего направления, как трансплантология. Зато тысячелетиями наращивала эти бесконечные варианты, а стало быть, в этом есть определенный биологический смысл, польза для выживания. О том, что само по себе разнообразие HLA помогает бороться с инфекциями, Кровь5 уже рассказывала. Теперь же мы предлагаем разобраться, а почему понадобилось такое усложнение?
Для начала вспомним из школьной программы, что ген — это инструкция для производства белка, и на самом деле интересует нас именно продукт этих генов, то есть белки HLA. А генотипирование — просто косвенный способ узнать, какой именно из множества возможных белков производит наш организм. Дальше, упоминая HLA, мы будем говорить именно о белках.
Никто не спрячется от клеточного «шредера»
Для простоты рассмотрим вирусную инфекцию. Когда вирус заражает клетку, ей надо каким-то образом подать сигнал бедствия, чтобы привлечь иммунитет на помощь. Она использует следующий механизм. Внутри клетки происходит постоянный круговорот различных белков: новые синтезируются, а старые или некачественные деградируют в специальных клеточных «шредерах», протеасомах. В них крупные белки измельчаются на мелкие кусочки, которые называются уже пептидами. Причем если клетка заражена, то рано или поздно несколько вирусных частиц нет-нет да и тоже угодят в протеасому, превратившись в кучку различных пептидов. К ним мы позже еще вернемся, а пока оставим их там и переместимся в область клетки под названием «эндоплазматический ретикулум» (ЭР), своего рода «погрузочный пункт» для HLA.
Формочки и фигурки
Структурно белки HLA устроены таким образом, что у каждого на макушке образуется специальная выемка, которая зовется антигенсвязывающей бороздкой. Можно представить, что это такая корзинка, куда помещаются пептиды. Основная задача HLA — укладывать в свою корзинку пептид, тем или иным способом образовавшийся в клетке, «всплывать» со своей ношей на ее поверхность и демонстрировать ее Т-лимфоцитам, патрулирующим организм. Так уж сложилось, что Т-клетки умеют распознавать врага, только если он лежит в этой корзинке, для них это своеобразный указатель: здесь может быть что-то интересное.
Вот только биохимическая природа взаимодействия белка HLA и пептида такова, что связаться с HLA может не любой пептид, а лишь такой, который «умещается» в пептидсвязывающей бороздке HLA. Причем вовсе не обязательно с такой точностью, как ключ должен подходить к замку, но хотя бы как в детской игре сортере: квадратик пролезает в квадратное отверстие, кружок в круглое и т. д. Поэтому, например, в треугольную корзинку можно положить множество треугольников разных цветов, лишь бы они были более-менее треугольными. Такая подгонка позволяет HLA зафиксировать пептид достаточно прочно, чтобы не выпускать его из своих цепких лапок, пока он будет добираться с ним до поверхности клетки и затем показывать его иммунным клеткам. Какая у корзинки будет «форма», зависит от того самого варианта HLA, которых, как мы помним, огромное множество.

Хватаем и своих, и чужих, а там разберемся
При этом в целом HLA безразлично, что хватать: пептид ли, происходящий из белков собственного организма или же из вирусных (тогда такой пептид, по сути, будет являться антигеном, то есть вызывает выработку антител). Главное, чтобы упаковался он впритык. Поэтому сидит HLA в своем примерочно-погрузочном пункте ЭР и играет в этот тетрис, прилаживая на себя то один пептид, то другой, пока не найдется подходящий по размеру и по фасону. И только тогда такой нагруженный HLA сможет позволить себе «выйти в люди», то есть пойти дефилировать по поверхности клетки. Кстати, у HLA есть даже свои «фасовщики», группа белков ERAAP, которые могут, если что, немного подогнать пептид по длине, слегка укоротив его. Но глобально перекроить пептид даже они не способны: он либо подходит конкретному варианту белка HLA, либо нет: либо слишком велик и не влезает, либо совсем не держится в корзинке и выпадает из нее.
А вот Т-лимфоциты в этом плане гораздо более разборчивы: подходит такой лимфоцит-охранник к клетке и заглядывает в корзинку, смотрит, что ему HLA интересного преподнесет. Если пептид знакомый, родной, то, значит, дома все свои, отбой тревоги. Однако если HLA демонстрирует Т-клетке какой-то незнакомый ей подозрительный предмет, такая Т-клетка активируется, переходит в режим боеготовности и, особо не церемонясь, убивает зараженную клетку.
И какой итог из всего этого следует?
Так вот фишка в том, что поскольку белки, произведенные разными аллелями HLA-генов, могут связывать разные по своей аминокислотной последовательности пептиды, то чем разнообразнее HLA, тем больше репертуар патогенов, который попадет в объятия хотя бы к одному из вариантов HLA. Если у нас есть и квадратные, и треугольные, и круглые варианты формочек HLA, то мы сможем распихать по ним и квадратные, и треугольные, и круглые фигурки (пептиды). Причем это работает как на уровне отдельно взятого индивидуума, так и популяции в целом. Если у человека одна хромосома кодирует, например, вариант под названием HLA-A*02, а вторая хромосома — HLA-A*29, то такая комбинация покрывает большее количество возможных сценариев, чем если бы обе хромосомы имели только HLA-A*02. И для борьбы с инфекций это хорошо. Ведь чем больше патогенных пептидов удастся засечь, схватить и вытащить на поверхность, тем большее количество Т-клеток отреагирует и обезвредит очаг заражения.
Так и на популяционном уровне: чем разнообразнее варианты HLA внутри группы, тем выше шансы, что в случае новой инфекции хотя бы кому-то удастся с ней справиться, активировав адаптивный иммунный ответ. В том числе поэтому небольшие племена, где все друг другу пусть и дальние, но родственники, оказывались настолько уязвимыми перед новыми для них завозными инфекциями: HLA у всех были слишком однообразными, приспособленными лишь к давно знакомым местным патогенам.
Хороший пример — распространенный в Западной Африке вариант HLA-B*53. Как показали исследования, его наличие коррелирует с защитой от тяжелого течения малярии. Оказалось, что именно эта разновидность белка HLA эффективно презентует Т-клеткам пептид, происходящий из малярийного плазмодия.
При этом в европейской популяции такой аллель встречается гораздо реже. Здесь малярия — не столь острая проблема.
Поэтому и донора легче найти среди этнически близких друг другу людей. А значит, очень важно, чтобы разнообразие в регистре доноров костного мозга поспевало за разнообразием вариантов HLA, которые природа успела напридумывать.
Автор этого текста Анастасия Павлова — наша читательница, студентка магистратуры биофака МГУ по программе «Геномика и здоровье человека». Это уже второй ее материал на страницах Кровь5. Первый, про работу лейкостима, читайте здесь. Если вы тоже хотите писать для Кровь5, присылайте свои тексты на hello@blood5.ru.
Иллюстрация: Юлия Замжицкая