Мария Портнягина
Трансплантация станет безопаснее благодаря точечному кондиционированию
Новые технологии снизят риски при пересадке костного мозга и позволят назначать трансплантацию ослабленным пациентам.
Перед трансплантацией стволовых клеток крови пациент проходит так называемое кондиционирование, то есть уничтожение его больных гемопоэтических стволовых клеток. Как правило, оно включает химиотерапию или облучение или и то и другое.
Эта процедура крайне рискованная, поскольку может привести к тяжелой инфекции, нарушению работы органов, бесплодию, а у детей и молодежи – еще и к проблемам развития. Существует и риск повреждения ДНК, что может даже спровоцировать новый рак.
Чтобы сделать кондиционирование более безопасным и щадящим для пациентов, сразу несколько американских компаний взялись за разработку новых методов проведения этой процедуры.
Причем они ставят и более амбициозные задачи: расширить спектр заболеваний, для лечения которых допустимо будет применять трансплантацию гемопоэтических стволовых клеток. И даже разработать технологию, при которой в определенных случаях пересадку можно будет проводить и без предварительного кондиционирования.
Биотехкомпании, такие как Jasper Therapeutics, Actinium Pharmaceuticals и Magenta Therapeutics, разрабатывают методы таргетной терапии. Ее суть в том, что в организм пациента направляются антитела, цель которых – уничтожить именно гемопоэтические стволовые клетки, не повреждая остальные органы и ткани. Тем самым удается снизить побочные эффекты, которые при традиционном кондиционировании испытывает весь организм.
– Кондиционирование похоже на жесткую перезагрузку, по сути, мы вынуждены ставить пациентов на грань смерти, – говорит онколог Кевин Хеллер, вице-президент Jasper Therapeutics. – Если таргетные методы кондиционирования докажут свою эффективность, это позволит использовать пересадку гемопоэтических стволовых клеток для лечения более широкого спектра заболеваний, включая хронические аутоиммунные болезни и генетические нарушения. Из-за высоких рисков, связанных с кондиционированием, врачи сейчас считают пересадку приемлемой при борьбе с раком, но не против этих заболеваний.
Согласно исследованию, проведенному в США Magenta Therapeutics, только 60% онкобольных, 34% пациентов с генетическими заболеваниями и 5% с аутоиммунными нарушениями от всех тех, кто имеет право на трансплантацию стволовых клеток крови, действительно проходят эту операцию. «Некоторые больные слишком слабы, чтобы подвергнуться суровому кондиционированию», – замечает соучредитель и директор Magenta Therapeutics Джейсон Гарднер.
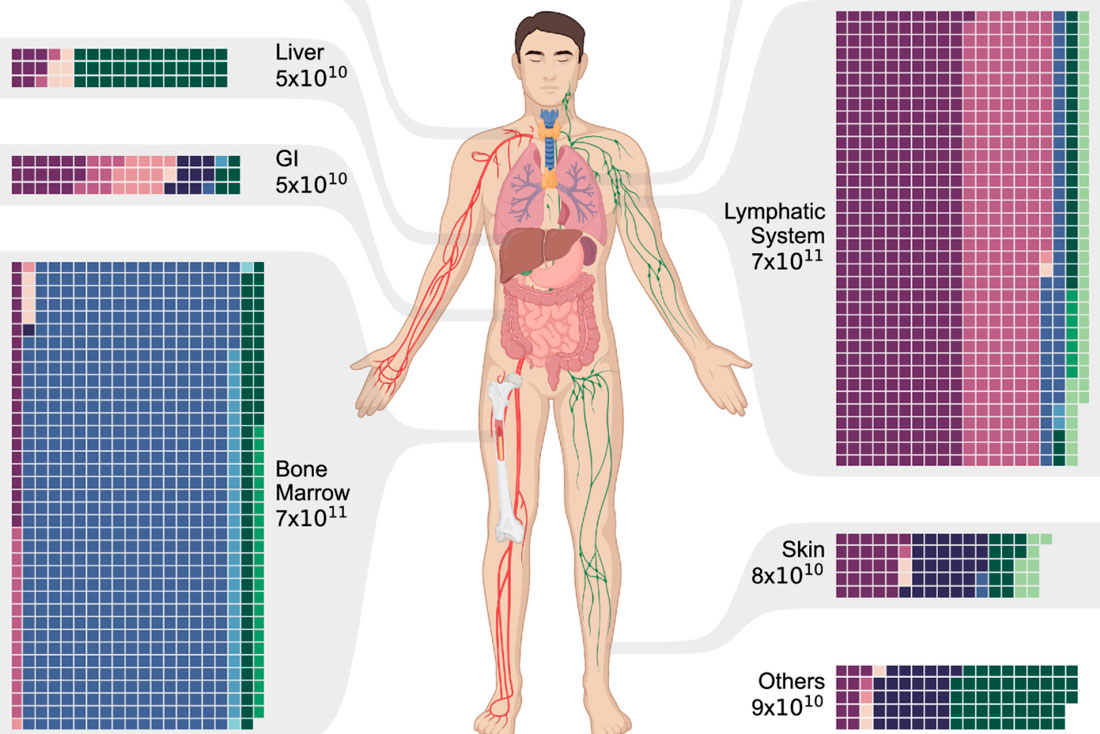
Методы таргетной терапии, уже проходящие клинические испытания, используют антитела, нацеленные на белки, расположенные на поверхности гемопоэтических стволовых клеток, – это белки CD45 и CD117.
– CD45 обнаруживается исключительно на гемопоэтических стволовых клетках и порождаемых ими иммунных клетках. То есть именно они оказываются мишенью для вводимых антител, которые при этом не затрагивают тромбоциты и эритроциты – тоже производные стволовых клеток крови, но не имеющие на своей поверхности этого белка, – объясняет Дейл Людвиг, главный научный сотрудник Actinium Pharmaceuticals.
Антитело, нацеленное на CD45, несет в себе радиоактивный йод-131, убивающий гемопоэтические стволовые и иммунные клетки. Компания сейчас испытывает эту технологию на пациентах с острым миелоидным лейкозом.
– CD117 в изобилии встречается на гемопоэтических стволовых клетках и в меньшей степени на их потомстве, – рассказывает Дэвид Скадден, профессор Гарвардского университета, соучредитель Magenta Therapeutics. – Этот белок является мишенью для антител, которые доставляют уничтожающий эти клетки токсин – аманитин.
Экспериментальные методы кондиционирования пока не отменяют химиотерапию и облучение. Однако, подчеркивают разработчики, позволят существенно снизить их дозировку. Еще одна проблема, требующая доработки, состоит в том, что белок CD117 содержится не только в гемопоэтических стволовых клетках, но и в клетках кожи и сосудистой системы, а также в зародышевых клетках, то есть риск бесплодия как побочный эффект кондиционирования сохраняется. И наконец, такое целенаправленное кондиционирование не устраняет риск иммунного отторжения после трансплантации.
Поэтому пока наиболее перспективным для использования новых методов считается лечение генетических заболеваний, где «зачистка» костного мозга может быть не такой полной, как при раке крови.
– Для тяжелого комбинированного иммунодефицита, при котором дети рождаются без лейкоцитов, замена всего лишь 1–2% гемопоэтических стволовых клеток может дать ребенку нормально функционирующую иммунную систему, – объясняет директор Graphite Bio Джош Лерер. – А для серповидноклеточной анемии, при которой нарушено строение белка гемоглобина, нужно заменить по крайней мере 20% гемопоэтических стволовых клеток. Сейчас в этих случаях перед трансплантацией используется традиционное кондиционирование. Но в наших ближайших планах – начать испытания таргетной терапии.
– Хотя новые методы все еще являются экспериментальными, исследователи захвачены перспективой снижения и, возможно, когда-нибудь устранения рисков, связанных с кондиционированием, – резюмирует профессор Скадден. – Без них это будет совершенно другой разговор между врачом, пациентом и его семьей. Можно больше говорить о лечении и меньше – об осложнениях.
Спасибо за ваше внимание! Уделите нам, пожалуйста, еще немного времени. Кровь5 — издание Русфонда, и вместе мы работаем для того, чтобы регистр доноров костного мозга пополнялся новыми участниками и у каждого пациента с онкогематологическим диагнозом было больше шансов на спасение. Присоединяйтесь к нам: оформите ежемесячное пожертвование прямо на нашем сайте на любую сумму — 500, 1000, 2000 рублей — или сделайте разовый взнос на развитие Национального регистра доноров костного мозга имени Васи Перевощикова. Помогите нам помогать. Вместе мы сила.
Ваша,
Кровь5